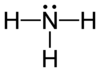|
|
| 第 1 行: |
第 1 行: |
| | [[分類:六年制學程/01]] | | [[分類:六年制學程/01]] |
| − | ==元素電子組態==
| + | {{:化學鍵}} |
| − | {{模板:元素電子組態}} | + | |
| − | | + | |
| − | ===電子式===
| + | |
| − | #中間寫元素名稱
| + | |
| − | #元素名稱的上左下右,分別代表外層電子的s、p<sup>x</sup>、p<sup>y</sup>、p<sup>z</sup>四個軌域。
| + | |
| − | #每個軌域可放0-2個電子,外層 sp 軌域共可放八顆電子,放滿時最穩定。
| + | |
| − | | + | |
| − | ==化學鍵(造分子)==
| + | |
| − | 參考資料:
| + | |
| − | *[http://highscope.ch.ntu.edu.tw/wordpress/?p=14212 高瞻計畫-化學鍵]
| + | |
| − | *[https://zh.wikipedia.org/zh-tw/化學鍵 中文維基百科-化學鍵]
| + | |
| − | ===分子內===
| + | |
| − | {|class=nicetable
| + | |
| − | |----
| + | |
| − | |
| + | |
| − | !離子鍵
| + | |
| − | !共價鍵
| + | |
| − | !金屬鍵
| + | |
| − | |----
| + | |
| − | !組成
| + | |
| − | !金屬+非金屬
| + | |
| − | !非金屬+非金屬
| + | |
| − | !金屬+金屬
| + | |
| − | |----
| + | |
| − | !作用<br/>方式
| + | |
| − | !正負電相吸
| + | |
| − | !共用電子對
| + | |
| − | !自由電子在相鄰<br/>原子間跑來跑去
| + | |
| − | |----
| + | |
| − | |能量
| + | |
| − | |150~400 KJ/mole
| + | |
| − | |150~400 KJ/mole
| + | |
| − | |50~133 KJ/mole
| + | |
| − | |----
| + | |
| − | !方向性
| + | |
| − | !無
| + | |
| − | !有
| + | |
| − | !無
| + | |
| − | |----
| + | |
| − | !例如
| + | |
| − | !NaCl、MgO(簡式)
| + | |
| − | !H<sub>2</sub>、H<sub>2</sub>O(分子式)
| + | |
| − | !Na(簡式)
| + | |
| − | |}
| + | |
| − | ====離子鍵====
| + | |
| − | 一方失去電子,一方得到電子
| + | |
| − | | + | |
| − | [[File:NaCl ionic.png|250px]]
| + | |
| − | | + | |
| − | ====共價鍵====
| + | |
| − | 共用電子對
| + | |
| − | #[http://winter.group.shef.ac.uk/orbitron/MOs/H2/1s1s-sigma/1s-H2-bonding-anim.swf 氫共價鍵]
| + | |
| − | #氧共價鍵:[[File:O2pic.PNG|300px]]
| + | |
| − | #水的共價鍵:影片 The Chemistry of Water ,字幕翻譯獎學金 200 元。
| + | |
| − | | + | |
| − | ====金屬鍵====
| + | |
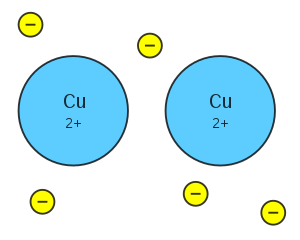
| − | #外層要有很多空軌域。
| + | |
| − | #把電子打出軌域的游離能較低。
| + | |
| − | #外層要有多餘的電子。
| + | |
| − | #電子在相鄰原子的空軌域跑來跑去,叫做「自由電子」。
| + | |
| − | #原子浸在自由電子形成的「電子海」中。
| + | |
| − | [[File:Metallic bond Cu.svg|300px]]
| + | |
| − | | + | |
| − | | + | |
| − | 影片:Metallic bonding 字幕翻譯獎學金 350 元。
| + | |
| − | | + | |
| − | 影片:Bonding in Metals 字幕翻譯獎學金 1000 元。
| + | |
| − | | + | |
| − | ===分子間===
| + | |
| − | #氫鍵:分子極性,正負電相吸。
| + | |
| − | #凡得瓦力:電子的機率運動,產生的瞬間偶極矩。
| + | |
| − | | + | |
| − | ==化學反應式==
| + | |
| − | <table>
| + | |
| − | <tr><td colspan=2>[[File:H2O 2D labelled.svg|200px]]
| + | |
| − | <tr><td>[[File:Water-3D-balls.png|100px]]<td>[[File:Water molecule 3D.svg|100px]]
| + | |
| − | </table>
| + | |
| − | | + | |
| − | 電解水(吸電能)
| + | |
| − | | + | |
| − | 2H<sub>2</sub>O→2H<sub>2</sub>+O<sub>2</sub>
| + | |
| − | | + | |
| − | 燃燒氫(放熱能)
| + | |
| − | | + | |
| − | 2H<sub>2</sub>O←2H<sub>2</sub>+O<sub>2</sub>
| + | |
| − | | + | |
| − | 合併上兩式:
| + | |
| − | | + | |
| − | 2H<sub>2</sub>+O<sub>2</sub>↔2H<sub>2</sub>O
| + | |
| − | | + | |
| − | [http://winter.group.shef.ac.uk/orbitron/MOs/H2/1s1s-sigma/index.html 氫分子電子軌域]
| + | |
| − | | + | |
| − | ===各種分子===
| + | |
| − | 負端寫右邊,正端寫左邊
| + | |
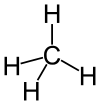
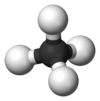
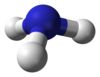
| − | #CH<sub>4</sub>:甲烷,屁、沼氣和瓦斯的主要成分。[[File:Methane-model-flat.svg]][[File:Methane-3D-balls.png|100px]]
| + | |
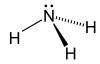
| − | #NH<sub>3</sub>:氨,俗稱阿摩尼亞,含於尿中。[[File:Ammonia-2D.svg|100px]][[File:Ammonia-2D-flat.png|100px]][[File:Ammonia-3D-balls-A.png|100px]]
| + | |
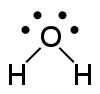
| − | #H<sub>2</sub>O:水。[[File:Water_with_4_single_electrons.svg|100px]][[File:Water-with-lone-pairs-3D-balls.png|100px]][[File:Water-2D.png|100px]][[File:Water-3D-balls.png|100px]]
| + | |
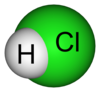
| − | #HCl:氫氯酸,俗稱鹽酸,因為氯取自鹽。[[File:Hydrogen-chloride-2D-dimensions.png|100px]][[File:Hydrogen-chloride-3D-vdW-labelled.png|100px]]
| + | |
| − | #CO<sub>2</sub>:二氧化碳。[[File:Carbon-dioxide-octet-dot-cross-2D.png|100px]][[File:Carbon-dioxide.svg|100px]][[File:Carbon-dioxide-3D-balls.png|100px]]
| + | |
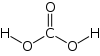
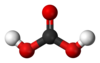
| − | #H<sub>2</sub>CO<sub>3</sub>:碳酸。[[file:Carbonic-acid-2D.svg|100px]][[File:Carbonic-acid-3D-balls.png|100px]]
| + | |
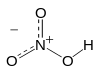
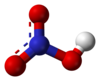
| − | #HNO<sub>3</sub>:硝酸。[[File:Nitric_acid_resonance_median.svg|100px]][[File:Nitric-acid-3D-balls-B.png|100px]]
| + | |
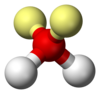
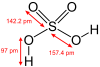
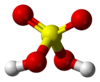
| − | #H<sub>2</sub>SO<sub>4</sub>:硫酸。[[file:Sulfuric-acid-2D-dimensions.svg|100px]][[File:Sulfuric-acid-Givan-et-al-1999-3D-balls.png|100px]]
| + | |
| − | #NaOH:氫氧化鈉。[[File:Sodium-hydroxide-crystal-3D-vdW.png|100px]]
| + | |
| − | #NaCl:氯化鈉,俗稱鹽。[[File:Sodium-chloride-3D-ionic.png|100px]]
| + | |
| − | #CaCO<sub>3</sub>:碳酸鈣。[[File:Calcium_carbonate.png|100px]][[File:Calcium-carbonate-xtal-3D-vdW.png|100px]]
| + | |
| − | #SiO<sub>2</sub>:[[二氧化矽]],形狀變化多端。
| + | |
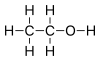
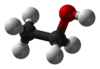
| − | #C<sub>2</sub>H<sub>5</sub>OH:乙醇,俗稱酒精。[[File:Ethanol-structure.svg|100px]][[File:Ethanol-3D-balls.png|100px]]
| + | |
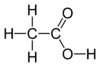
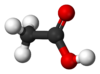
| − | #CH<sub>3</sub>COOH:乙酸,俗稱醋酸。[[file:Acetic-acid-2D-flat.png|100px]][[File:Acetic-acid-3D-balls.png|100px]]
| + | |
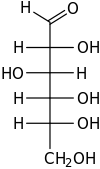
| − | #C<sub>6</sub>H<sub>12</sub>O<sub>6</sub>:葡萄糖,光合作用的產物。[[File:DGlucose Fischer.svg|100px]][[File:D-glucose-chain-3D-balls.png|200px]]
| + | |